 头颈癌
头颈癌
 2021-04-14
2021-04-14
近日,FDA授予可溶性LAG-3蛋白Eftilagimod alpha(又名IMP321)快速通道称号,一线治疗复发/转移性头颈部鳞状细胞癌(HNSCC)患者。
Eftilagimod alpha是一款可溶性LAG-3融合蛋白,可与PD-1/PD-L1抑制剂联用,提高免疫疗法耐药患者的疗效。
▌全球第六大癌:头颈癌
头颈部鳞状细胞癌(HNSCC)是全球第六大常见癌症,2018年约有80万新确诊患者,约45万患者因此去世。
头颈癌是个“大家族”,包括口腔、鼻腔、咽部和喉部位的癌症。其中,90%以上为HNSCC。
头颈癌的发生与不良的生活习惯有很大关系,如抽烟、酗酒或者嚼槟榔等。此外,人乳头瘤病毒(HPV)感染相关口咽癌发病率也在逐年上升,主要危险因素是口腔性行为,需要引起重视。
去年6月,FDA批准九价HPV疫苗新适应症,用于预防HPV引起的口咽癌和其他头颈部癌症,这让预防一部分头颈癌的发生成为了可能。
而对确诊头颈癌的患者来说,治疗方案除手术、化疗外,还有最近火热的免疫疗法纳武利尤单抗和帕博利珠单抗等。
不过,PD-1/PD-L1抑制剂只对部分患者有效,而且在应答的患者中,仍有10%-15%的人出现耐药,而联合用药有望提高免疫抑制剂的疗效,减少耐药的发生。
▌LAG-3融合蛋白:Eftilagimod Alpha
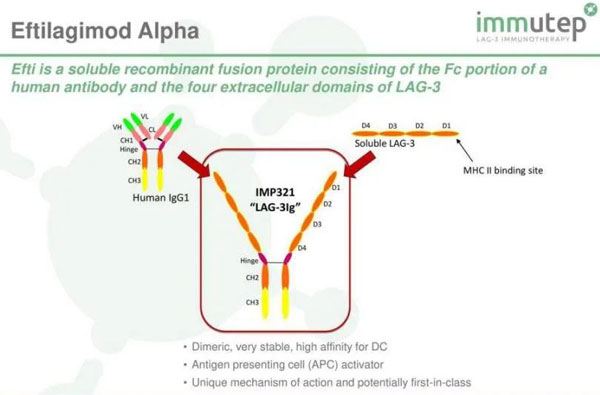
Eftilagimod alpha是一款可溶性LAG-3融合蛋白,在与“K药”帕博利珠单抗联用治疗非小细胞肺癌的临床试验中,显示出提高帕博利珠单抗缓解率的效果。
LAG3(淋巴细胞激活基因3)是一种免疫检查点受体蛋白,能够调控T淋巴细胞和抗原呈现细胞(APCs)的信号通路。临床前研究显示,阻断LAG-3可以促进T细胞增殖,增强其免疫功能。
▌客观缓解率39%,联合用药疗效更佳!
这一认定是基于TACTI-002阶段3试验的积极结果。该试验共入组88名患者,包括非小细胞肺癌患者。其中,HNSCC队列有28例患者,其中18例患者的疗效和安全性可评估。
中位随访时间9.5个月,Eftilagimod alpha联合帕博利珠单抗治疗组患者的客观缓解率(ORR)为38.9%。其中,疾病控制率为50%,约11%的患者治疗后完全完全缓解。
HNSCC队列组的中位PFS为4.26个月,9个月和12个月的OS率分别为67%和60%。数据截止时,有7例HNSCC患者仍在接受治疗。
结果表明,即使在PD-L1表达较低且通常对治疗没有反应的患者中,Eftilagimod alpha对头颈部鳞状细胞癌患者产生深刻而持久的反应。
此外,该组合疗法的耐受性良好。基于这一试验的结果,3期试验探索Eftilagimod alpha联合帕博利珠单抗,一线治疗HNSCC的疗效和安全性。
▌相关药闻:新剂量方案获批
此外,最近,FDA还批准了靶向抗癌药西妥昔单抗一种新剂量方案:2小时静脉输注500mg/m2、每2周一次,用于治疗K-Ras野生型、EGFR表达阳性的转移性结直肠癌(mCRC)和头颈部鳞状细胞癌(SCCHN)。
西妥昔单抗是全球首个靶向EGFR的单抗,于2004年在美国获首批。
截至目前,该药已在全球100多个国家批准上市,获批的适应症有晚期或转移性头颈癌、K-Ras野生型、EGFR表达阳性的转移性结直肠癌患者。
西妥昔单抗新剂量的批准,为临床医生和患者提供一种新的治疗方案。