 其它肿瘤
其它肿瘤
 2021-09-15
2021-09-15
近日,FDA接受了抗PD-1抗体替雷利珠单抗(Tislelizumab)的生物制剂许可申请(BLA),用于既往接受过全身治疗的、不可切除的复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者;预计2022年7月12日做出审批回复。
这是替雷利珠单抗在中国获得五个适应症批准后,首次在中国以外的国家递交的监管备案。
壹丨60万食管癌患者,中国占一半!
食管癌是全球第七大最常见的癌症,也是第六大癌症死因。该病两种最常见类型是鳞状细胞癌(ESCC)和腺癌(EAC),分别约占85%和15%。
2020年,全球约有60万新确诊病例,55万死亡病例;仅在我国,确诊和死亡病例均超30万,占了全球的“半壁江山”。
我国的食管癌高发,与一些不良的饮食习惯有很大的关系,如烟熏腊肉等腌制食品、“趁热吃”的进食习惯、抽烟喝酒等等。
好医友医疗网美国肿瘤内科专家Edward Wagner博士指出,食管癌进展迅速,2/3的患者确诊时已为晚期或发生转移,中位生存期在8-10个月左右,而五年存活率更是不到5%。
目前,食管癌的治疗已经形成以外科手术治疗为主,再辅助放、化疗等的综合治疗模式。但失去手术机会的患者临床治疗选择有限,亟需更好的疗法。
不过,近些年来,免疫疗法PD-1/L1抑制剂如纳武利尤单抗、帕博利珠单抗等的获批,为食管癌的治疗带来希望。这些药物无论是单药使用还是与其他化疗联用,或者作为一二线疗法、辅助疗法等,延长了患者的生存期,提高了患者的生存质量。
贰丨替雷利珠单抗,在中国获批多种适应症
替雷利珠单抗(BGB-A317)是一种人源化IgG4抗PD-1单克隆抗体,专门设计用于最大限度地减少与巨噬细胞上FcγR的结合。
在临床前研究中,与巨噬细胞上的FcγR结合,已被证明可以通过激活抗体依赖性巨噬细胞介导的T杀伤细胞来降低PD-1抗体的抗肿瘤活性。
目前,替雷利珠单抗作为单一疗法和与其他疗法联用,治疗广泛实体瘤和血液癌症的全球多项临床试验正在进行中,包括NSCLC、肝癌、膀胱癌、胃癌、鼻咽癌等。
截至现在,替雷利珠单抗共获得中国国家药监局(NMPA)批准的五个适应症
2019年12月,获批治疗先前接受过至少两种疗法的复发或难治性经典型霍奇金淋巴瘤(cHL)患者;
2020年4月,获批治疗PD-L1高表达、且在治疗期间疾病仍进展的局部晚期或转移性尿路上皮癌(UC)患者;
2021年1月,获批一线治疗晚期鳞状非小细胞肺癌患者,是首项肺癌适应症;
2021年6月,获批两项适应症,分别为:(1)联合化疗一线治疗晚期非鳞状NSCLC患者;(2)既往接受过治疗的、不可切除肝细胞癌(HCC)患者;
同时,该药在中国也正在接受监管审查,用于二线或三线治疗局部晚期或转移性非小细胞肺癌患者、二线治疗局部晚期或转移性ESCC患者,些患者在一线标准化疗后疾病进展或不耐受。
总生存期显著改善,临床试验结果亮眼!
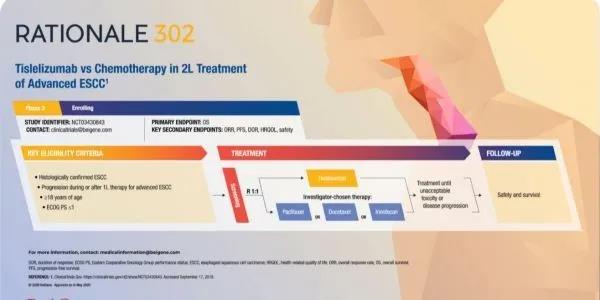
这一BLA得到了全球3期RATIONALE302临床试验积极结果的支持。这是一项随机、开放标签、多中心全球3期试验,旨在评估替雷利珠单抗与化疗相比,二线治疗晚期或转移性食管鳞状细胞癌患者的疗效和安全性。
该试验入组了11个国家的512例患者,按1:1的比例随机至替雷利珠单抗治疗组和化疗组,主要终点是意向治疗人群(ITT)中的总生存期(OS)。
在2021年美国临床肿瘤学会年会(ASCO2021)上公布的结果显示:
与化疗相比,替雷利珠单抗治疗组患者的总生存期具有统计学和临床意义上显著提高,达到了该试验的主要终点。
与化疗相比,抗PD-1抗体替雷利珠单抗已被证明可以显著提高各种实体瘤和血液系统恶性肿瘤患者的生存期。期待该药能够早日获批,走出国门,造福全球各地的食管癌患者。