 肺癌案例
肺癌案例
 2019-11-18
2019-11-18
“根据TCGA数据库显示,只有6名肺癌患者(0.55%)发现了TSC1突变,只有1.75%的患者出现了TSC1拷贝数丢失。同样,在1090例肺癌患者中,只有31例肺癌患者(2.84%)携带了ROS1突变,但没有患者同时携带这两种有害的基因突变。因此,这名患者的肺癌非常罕见,几乎从未遇到。”——美国肿瘤专家迈克尔·卡斯特罗(Michael Castro)博士

通过好医友中美远程会诊平台,迈克尔·卡斯特罗(Michael Castro)博士看诊了一名65岁的肺腺癌多发转移患者。在过去40多年里,患者廖先生每日烟酒不离手,后来患上高血压,一直吃药控制。去年10月,廖先生被诊断为局限性左胸腔腺癌,两次基因检测显示ROS1基因重排、TSC1和TP53突变。
ROS1基因重排
卡斯特罗博士解析:ROS1编码酪氨酸激酶受体,位于细胞膜上,通过MAP激酶、PI3K和JAK/STAT信号通路向细胞核传递生长信号。2007年研究发现,当发生基因重排时,ROS1可激活下游通路,如ERK、AKT和STAT,促进无数基因转录,从而驱动癌细胞的恶性行为,包括癌细胞增殖不受控、细胞存活、放化疗抵抗、阻断癌细胞死亡途径、肿瘤侵袭、转移以及免疫逃避。大约0.5-2.0%的非小细胞肺癌患者其发病原因为ROS1基因重排。在中国,该发病率略高,为2-3%。
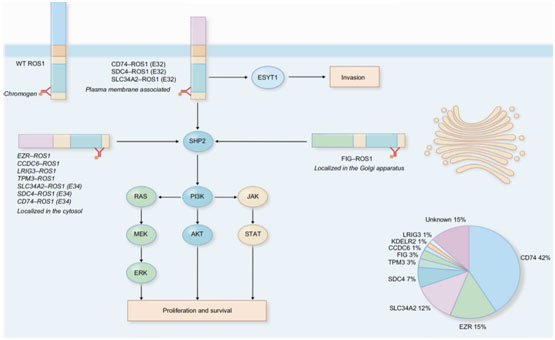
图示:ROS1是一种膜结合分子,能够激活PI3k、MAP激酶和JAK/STAT通路中的信号通路。
卡斯特罗博士指出,ROS1重排检测是诊断的必要条件,使用克唑替尼是首选的治疗方案。基于ROS1与ALK之间的重叠性,使用针对ALK突变而开发的克唑替尼具有很高的反应率。
TSC1/2突变
卡斯特罗博士解析:TSC1和TSC2基因是肿瘤抑制基因,突变后抑制功能失活。TSC1和TSC2分别编码错构瘤蛋白(Hamartin)和薯球蛋白(Tuberin),可于体内形成Hamartin-Tuberin复合体,作为MTORC1的关键负调控因子,MTORC1是一种调节癌细胞生长的中枢生长因子。由于肿瘤中TSC1被敲除,控制GTPase的制动器失效,MTORC1功能不受控从而导致肿瘤生长和ROS1上游阻断抵抗。TSC1 / 2的功能作为传感器,是多途径控制癌细胞生长和增殖的整合器或分子交换板。
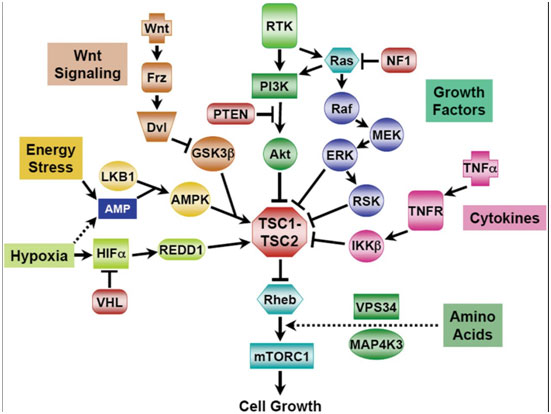
图示:TSC1/2功能成为激活MTOR的中央枢纽。
卡斯特罗博士指出,TSC1/2突变能够上调PI3K通路的下游激活,从而对克唑替尼产生耐药性。在某些临床情况下,阻断MTOR是逆转耐药性的一种有效策略。而Everolimus (依维莫司,Afinitor?)可靶向TSC1/2下游因子MTORC1。因此,可考虑联合使用克唑替尼和依维莫司,以同时阻断这两种驱动突变。
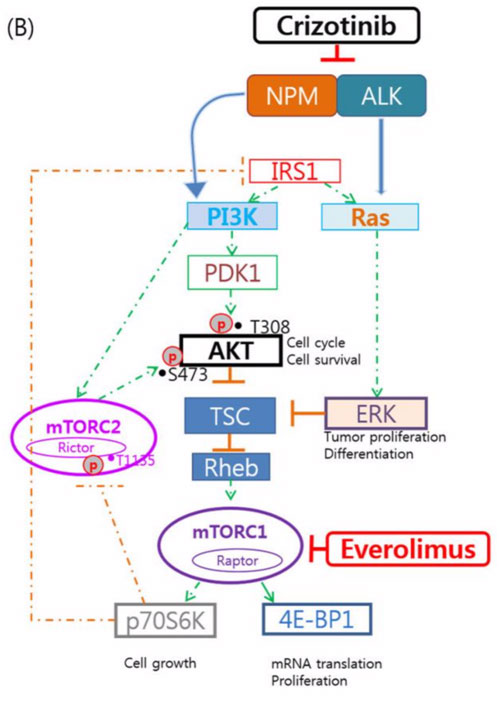
图示:联合使用克唑替尼和依维莫司的机制。
“然而,在临床上还没有联合应用克唑替尼和依维莫司的治疗经验。因此,最佳剂量和安全性尚未得到研究。”卡斯特罗博士说:“最有可能的情况是,同时使用这两种药物可能需减少药物剂量。建议先单独使用标准剂量的克唑替尼,严密监测血清肿瘤标志物。若未产生反应或疾病进展,再考虑联合治疗方案。”
TP53突变
卡斯特罗博士解析:患者有TP53突变,这是人类癌症最常见的突变之一。TP53是一个关键的肿瘤抑制基因,它通过在G1细胞周期检查点暂停细胞分裂来保护基因组的完整性,以便进行DNA修复。此外,当DNA复制的保真度受到突变或毒性的威胁时,TP53会触发细胞凋亡。有害的TP53突变,会造成基因组不稳定,正常细胞死亡途径受损。
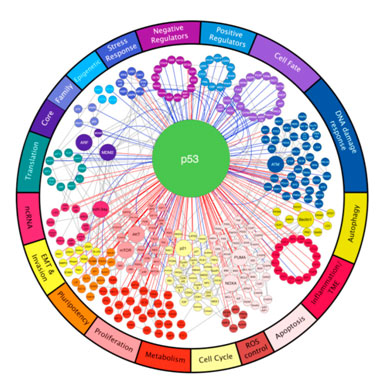
图示:TP53参与了大多数癌症的标志性行为。
卡斯特罗博士说:“TP53缺失的潜在解决方案,包括铂类化疗(如顺铂和卡铂)、 PARP敏感性抑制剂(如奥拉帕尼),以及被称为ATM和ATR抑制剂的两种新药物。临床试验中有一些新药可能有助于靶向这些目标。”
卡斯特罗博士认为,由于患者存在关键的癌症遗传学改变--抑癌基因TSC1突变和致癌基因ROS1重排,因此,癌症表现为侵袭增长、基因组不稳定性以及对放化疗的耐受性并不足为奇。利用ROS1和TSC1突变寻找治疗靶点是一种精准医疗策略。根据其他接受ROS1靶向治疗的患者的临床经验,其疗效积极,生存期比化疗延长3.5倍。将依维莫司纳入治疗,患者的生存期有望超过中位数41个月。
此外,卡斯特罗博士还介绍阻断下游信号通路的其他策略,包括糖尿病药物二甲双胍(通过阻断Akt和MTOR来阻断PI3K通路,从而具有抗癌特性)、植物源性物质小檗碱、刺果番荔枝的叶子(Graviola茶);并就三种挽救性治疗方案作了说明,包括化疗、免疫治疗(检查点抑制剂)和Adavosertib临床试验。他希望这些癌症治疗方法能帮助患者缓解病情。
资料来源:好医友中美远程会诊平台