 医学资讯
医学资讯
 2020-04-15
2020-04-15
近期,《科学》杂志发表了一项宾夕法尼亚大学医学院研究团队的研究:一种此前在癌症临床试验中失败的在研PARP抑制剂维利帕利(Veliparib),可以通过改造后大大增抗癌能力。
更令人意外的是,Veliparib的复合物还能“反向调节”,在不杀死细胞的情况下抑制PARP-1酶,有望用于治疗以抑制PARP-1为目标的心脏病和其他非癌症疾病。
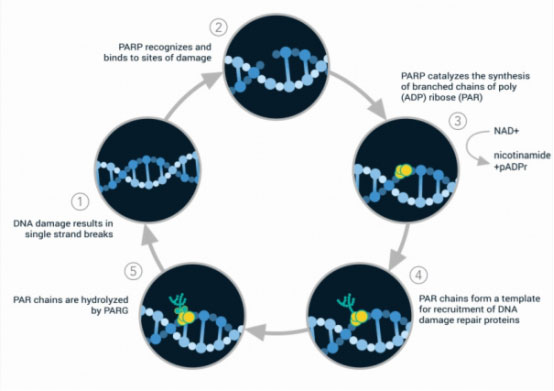
PARP-1是一种DNA修复酶,在DNA损伤断裂时会被激活,从而识别并结合到DNA的断裂位置上,并进一步激活、催化受体蛋白的聚ADP核糖基化作用,参与DNA的修复过程。
目前为止,美国FDA已批准了四种PARP抑制剂,分别是奥拉帕利(Olaparib)、芦卡帕利(Rucaparib)、尼拉帕利(Niraparib)、他唑拉帕利(Talazoparib),适应症主要是卵巢癌和乳腺癌等。
PARP抑制剂正常作用机制
人体里住着两个“细胞修理工”:PARP和BRCA,主要负责修复细胞内DNA突变。对于细胞而言,这套“双保险机制”缺一个可以,但缺俩就不行了。如果BCRA正常,PARP抑制剂仍阻挡不了癌症细胞的修复,但如果BCRA无法正常工作,PARP抑制剂就可实现只杀死癌细胞而不杀正常细胞的效果。
PARP抑制剂+BRCA基因突变就是所谓的“合成致死”策略,简单来讲就是这两种基因/蛋白同时发生突变时导致癌细胞死亡。
由BRCA突变驱动的癌细胞通常缺乏基于BRCA的DNA修复能力,而PARP抑制剂会进一步降低它们修复DNA断裂的能力,使癌细胞死亡。因此,PARP抑制剂成为癌症靶向治疗的新利器,可单用或与化疗和放疗等治疗方法联用,诱导DNA损伤,改善癌症患者的预后。
尽管几种PARP-1抑制剂临床效果不错,但针对这类药物仍有一个谜。它们通过与PARP-1酶的活性位点紧密结合,有效地抑制这种酶——然而,只有部分PARP抑制剂能显示出杀死癌细胞的效力,有些则没有。
PARP抑制剂反响调节
近年来,越来越多的研究表明,PARP抑制剂不仅可通过抑制PARP-1活性来杀死癌细胞,还可以通过某种方式将PARP-1酶捕获,困在其试图修复的DNA断裂上。
当细胞分裂时,将PARP酶粘附在细胞的DNA上可有效地杀死细胞,不过PARP抑制剂在DNA上“捕获”这种酶的能力各不相同。所以,这也可以解释只有部分药物具有抗癌作用。
而在这项新的研究中,研究团队使用复杂、灵敏的技术,证明了PARP抑制剂与PARP-1酶的结合方式,可以削弱或增强这种酶与DNA断裂的结合。
Veliparib是一种候选PARP-1抑制剂,尚处于临床研究中。尽管在联合化疗治疗乳腺癌和肺癌的临床研究中均失败了,但它也被“解锁”了新技能:可削弱PARP-1酶对DNA的控制。
研究小组通过化学方法修饰Veliparib,从而大大提高了其在DNA上捕获PARP-1的能力,与未经修饰的Veliparib相比,增强了PARP-1与DNA断裂结合的能力。
在不同类型的癌细胞体外实验中,这反过来极大地增强了其杀死癌细胞的作用。研究人员发现了PARP抑制剂和PARP-1酶之间复杂的相互作用,并揭示了不同的细胞杀伤效果。
这一新发现不仅可以用来开发更有效的抗癌PARP抑制剂,还可用来开发不通过在DNA上捕获PARP-1杀死细胞的PARP抑制剂,后者可用于治疗炎症、心脏病、中风以及其他已被证明与PARP活性相关的疾病(可能还包括新冠肺炎)。