 医学资讯
医学资讯
 2020-12-01
2020-12-01
近日,创新T细胞受体(TCR)疗法Tebentafusp(IMCgp100)的3期试验数据公布,结果亮眼。
分析显示,与现有疗法相比,Tebentafusp使得初治转移性葡萄膜黑色素瘤(UM)患者的死亡风险降低49%,总生存期(OS)显著提高。
这是TCR疗法取得的首个3期积极结果,也是双特异性疗法在实体瘤中取得的首个3期阳性试验。
如果获得批准,Tebentafusp将成为40年来首个改善UM患者生存期的新疗法。完整的结果将在下个月举行的2020年ESMO免疫肿瘤学虚拟大会上发表。
▌对免疫疗法不“感冒”的眼癌
好医友介绍,葡萄膜黑色素瘤(UM)是成年人眼内最常见的恶性肿瘤,起源于眼睛葡萄膜区的黑色素细胞。在国内,它仅次于婴幼儿视网膜母细胞瘤,居眼内恶性肿瘤的第二位。近50%的眼部黑色素瘤患者发生葡萄膜黑色素瘤转移,中位生存期约为1年。
一半的UM患者经历全身治疗后仍会发生转移,其中,肝脏是最常见的转移部位。UM一旦发生转移,即便是全身治疗也很少能够延长生命,通常在1年内死亡,致死率极高。
近年来,免疫检查点抑制剂的应用已改变了皮肤黑色素瘤患者的生存结局,然而,免疫疗法对转移性葡萄膜黑色素瘤患者通常无效。
目前,UM患者普遍缺乏有效的治疗方法,而美国国家综合癌症网络(NCCN)《UM指南》建议将临床试验作为转移性疾病的首选方案,但迄今为止,成功的甚少。
由于治疗方案有限,30多年来,转移性UM患者的预后并没有明显改善,亟需更有效的疗法。
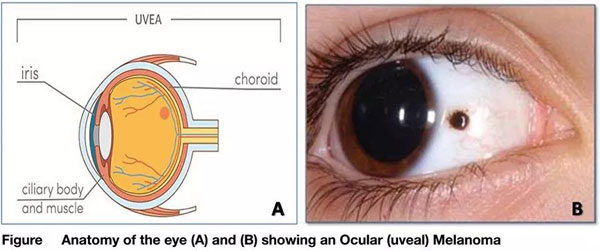
▌精准杀伤癌细胞:Tebentafusp
Tebentafusp是一种新型双特异性蛋白质,由将靶向肿瘤抗原的TCR与结合CD3的免疫效应结构域(immune-effector domain)联合而成。
该药被设计为专门靶向与黑素瘤相关抗原gp100的肽复合物,该肽在黑素瘤细胞中过度表达,在正常黑素细胞中弱表达,在其他组织中表达最低。
Tebentafusp通过重新定向和激活T细胞,来识别和杀死肿瘤细胞。此前,FDA曾授予tebentafusp快速通道认定和“孤儿药”称号。
▌更具优势的TCR疗法
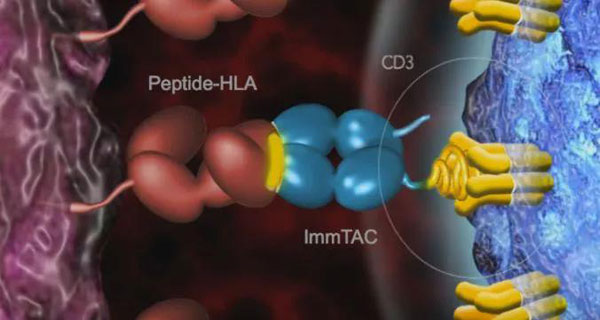
T细胞受体(TCR)改造的ImmTAC平台,可以将其理解为抗肿瘤免疫激动单克隆T细胞受体,它本质上属于一类新型的双特异性生物大分子,是由工程化改造的TCR以及抗CD3的scFv组成。
TCR靶向结构域与细胞表面的人白细胞抗原(HLA)-肽(pHLA)复合物相结合,而抗CD3效应结构域参与并激活CD3+ T细胞。HLA提供的肽抗原约占蛋白质组的90%,为ImmTAC分子提供了广泛的潜在靶点。
CD3结构域允许ImmTAC分子与没有特异性T细胞的癌细胞接触,通过T细胞的这种重定向,ImmTAC分子有望克服免疫检查点抑制剂的缺点。
从理论上讲,ImmTAC技术要比PD-1/PD-L1抗体更具有优势。因为检查点抑制剂需要预先存在的癌症特异性T细胞,才能诱导癌细胞裂解,响应率较低。
而ImmTAC分子通过特异性高亲和力的TCR,识别肿瘤特异性抗原,激活T细胞发挥细胞杀伤作用,有望突破现有抗体类药物的局限。
▌临床试验数据亮眼,死亡风险降低49%!
名为IMCgp100-202的3期临床试验(NCT03070392),入组378名既往未接受治疗(初治)的转移性葡萄膜黑色素瘤患者,评估了Tebentafusp与研究人员选择的疗法来治疗的效果。
这些疗法包括达卡巴嗪(Dacarbazine)、抗CTLA-4疗法“Y药”伊匹单抗、抗PD-1疗法“K药”帕博利珠单抗。
患者按2:1的比例随机分配接受药物或安慰剂治疗,主要终点是OS,关键次要终点是无进展生存期、客观缓解率、缓解时间和疾病控制率。
中期分析结果显示:
与其他疗法相比,tebentafusp治疗组目前的一年生存期为73%,显著优于其他疗法组的58%。达到其主要临床终点。不过,目前的数据尚未完全成熟。
此外,Tebentafusp还将死亡风险降低了49%,而其他疗法达卡巴嗪为6%、伊匹单抗为12%、帕博利珠单抗为82%,达到了具有统计学意义的预定义界值。
对于转移性葡萄膜黑色素瘤这一生存率极低且亟需新疗法的疾病,TCR疗法Tebentafusp提高了这类患病人群的生存期。
同时,这一试验结果也让我们看到了创新型TCR疗法在临床试验中的良好疗效。未来,TCR疗法不仅能改善UM患者生存期,还有望造福更多的癌症患者。