 乳腺癌
乳腺癌
 2021-11-15
2021-11-15
近日,靶向TROP-2的抗体偶联药物Trodelvy(Sacituzumab Govitecan-hziy)在中国一项临床研究中传出好消息,数据惊艳!
结果显示:在三阴性乳腺癌患者中,Trodelvy的总缓解率为38.8%,达到其主要终点。
去年4月,Trodelvy获FDA加速批准上市,治疗既往接受过至少2种疗法的转移性三阴乳腺癌(mTNBC)成人患者,成为全球首个获批的靶向TROP-2的抗体偶联药物。
1/ 最凶险的乳腺癌,存活时间“缩水”一半!
目前,乳腺癌是全球女性第一大癌症,全球每年确诊超过200万例。
而三阴乳腺癌(TNBC)约占所有乳腺癌的15%,是最具侵袭性的乳腺癌类型,且在绝经前的年轻女性中比较常见,又被称为“红颜杀手”。
由于TNBC患者的雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)均为阴性,靶向这些受体的特效药通常无效,治疗选择受限。
而且,三阴性乳腺癌复发和转移的几率高于其他的乳腺癌类型。一般乳腺癌的转移复发的平均时间约为5年,五年生存率为28%;但在TNBC中,这些时间“缩水”了一半。患者的转移复发的平均时间约为2.6年,五年生存率为12%,
对于既往接受过其他疗法的TNBC患者,临床可用的疗法积极有限。
2/ 抗体偶联药物:Trodelvy
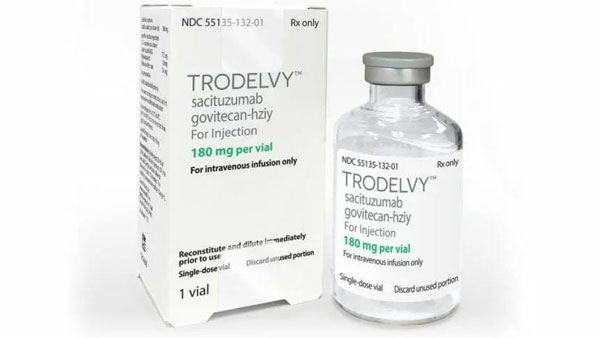
Trodelvy(Sacituzumab Govitecan)是一款靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药(ADC),由将靶向TROP-2抗体与化疗药物伊利替康的活性代谢物SN-38连接构成。TROP-2抗体药物能靶向癌细胞,并与Trop-2结合,递送化疗药SN-38至癌细胞内部,从而杀死癌细胞。
Trop-2是一种在多种实体瘤中过度表达的细胞表面蛋白,包括转移性TNBC和转移性尿路上皮癌等,其高表达可能增加肿瘤复发和不良预后的风险。
根据ASCENT3期研究提交的数据,Trodelvy已在全球多个国家/地区获批二线治疗转移性TNBC,包括澳大利亚、加拿大、英国、瑞士和美国。
此外,今年4月,该药还获FDA加速批准,治疗局部晚期或转移性尿路上皮癌患者,并获得了治疗TNBC的完全批准。
2020年5月,中国国家药品监督管理局(NMPA)药品审评中心(CDE)对sacituzumab govitecan的生物制品许可申请(BLA)进行了优先审评,用于治疗已接受两次或更多全身性疗法的不可切除的局部晚期或转移性TNBC成人患者。
同年10月,sacituzumab govitecan还被纳入由国家癌症防治中心乳腺癌专家委员会等专业委员会新修订版的《2020中国晚期乳腺癌规范诊疗指南》。
目前,该药作为单一疗法或与其他药物联用,在包括转移性尿路上皮癌、乳腺癌、肺癌等在内多种实体瘤中进行进一步评估。
3/ 总缓解率38.8%,Trodelvy值得中国患者期待!
EVER-132-001是一项单臂、多中心2b期临床研究,在中国入组80名患者,主要评估Trodelvy在不可切除的局部晚期或转移性TNBC成年患者中的疗效和安全性,这些患者既往接受过两次或多次全身治疗,其中至少一种用于治疗转移性疾病。
结果显示:
Trodelvy治疗组的总缓解率(ORR)为38.8%,达到了该试验的主要终点,且这一结果与全球第3阶段ASCENT研究中显示的结果一致。
Trodelvy的安全性与之前研究报告的相似,未发现新的安全性信号。
这项研究结果再次证实了sacituzumab govitecan在治疗三阴性乳腺癌患者方面的临床益处,有望改变中国三阴性乳腺癌患者的治疗前景。
上一篇:每年40万人!乳腺癌治疗耐药怎么办?创新疗法有望破解难题
下一篇:没有了