 结直肠癌
结直肠癌
 2020-07-02
2020-07-02
近日,美国FDA宣布:批准“K药”帕博利珠单抗(商品名:可瑞达Keytruda)扩展适应症,用于不可切除或转移性高微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)结直肠癌患者的一线治疗。
这是首个无需与化疗联用,治疗此类结直肠癌患者的一线免疫疗法,同时也是首个基于MSI-H或dMMR生物标志物获批的一线免疫疗法。
MSI-H/dMMR结直肠癌
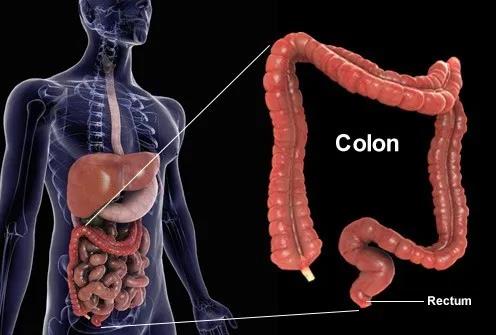
正常细胞里,大约有十几个基因和蛋白质专门负责DNA错误修复,比如MSI和MMR。
在DNA不断复制中,由于一些偶然因素会不可避免地发生错误。这时,这些“修复师”就会马上去修复错误,从而维护细胞中遗传物质的稳定。
但在一些患者的肿瘤组织中,由于基因突变等原因导致这些“修复师”缺席,DNA复制中的错误无法得到及时修复,就给了癌细胞产生致癌突变的机会,这些癌细胞携带大量基因突变。
不过,“欲使其灭亡,先令其疯狂”。这些携带大量突变的肿瘤,对免疫治疗药物更敏感。
大约5%的转移性结直肠癌患者携带MSI-H或dMMR肿瘤。MSI-H和dMMR肿瘤由于细胞中DNA修复机制的异常,导致其基因组中携带大量基因突变,使得其对免疫检查点抑制剂更为敏感。
MSI-H是由于错配修复缺陷,导致DNA的特定区域出现非常多的基因突变。最早发现于结直肠癌,也可发生于胃癌、子宫内膜癌等。
错配修复基因(MMR)具有修复DNA碱基错配的功能,可维持基因组的稳定性和降低自发性突变的几率。
dMMR是指MMR缺失,如果用肿瘤标本做4个错配基因的免疫组化蛋白检测,即:MLH1、PMS2、MSH2及MSH6,只要这四个蛋白里面任何一个表达缺失的,肿瘤就属于dMMR。
目前,主要采用三种方法检测 MSI/MMR
(1)免疫组化法(IHC):检测MMR异常蛋白;
(2)聚合酶链式反应(PCR):检测MSI;
(3)二代基因测序(NGS):可以更快速准确地检测整个基因组的MSI,同时进行肿瘤相关基因测序,但费用相对较高。
关于“K药”
帕博利珠单抗是一种人源化的单克隆抗体,通过阻断PD-1与其受体PD-L1和PD-L2的相互作用,从而激活T淋巴细胞来对抗癌细胞。
通过阻止这种信号通路,帕博利珠单抗可帮助人体的免疫系统对抗癌细胞,并让MSI-H或dMMR转移性结直肠癌患者获益。一些MSI-H的患者对PD-1/PD-L1抑制剂的应答比例明显更高,达到约50%。
临床试验
FDA对这一适应症的批准基于一项多中心、国际、开放标签、主动对照、随机试验的结果,该试验在307例MSI-H或dMMR转移性结直肠癌患者中比较了帕博利珠单抗和化疗的效果和安全性。
该研究表明,通过盲法独立审查评估,接受帕博利珠单抗治疗的患者的无进展生存期(PFS)在统计学上有显著改善。帕博利珠单抗组的中位PFS为16.5个月,标准护理组的中位PFS为8.2个月。不过仍需要进行长期的分析以评估其对生存的影响。
其实早在2017年,帕博利珠单抗就已获FDA批准,成为全球首个基于生物标志物的“不限癌种”抗癌药,治疗MSI-H/dMMR实体瘤患者。
而在今年6月,FDA又批准了帕博利珠单抗第二个“不限癌种”的新适应症,二线单药治疗不可切除或转移性的、具有高组织肿瘤突变负荷(TMB-H)的实体瘤患者,这些患者既往治疗后疾病进展且无更佳的替代疗法。
截至目前,K药已在全球获批24个适应证,在国内获批5个适应证。这项免疫疗法正在惠及越来越多的肿瘤患者。