 神经系统疾病
神经系统疾病
 2021-08-09
2021-08-09
近日,Ganaxolone向美国FDA递交一份新药申请(NDA),用于治疗CDKL5缺乏症(CDD)相关的癫痫发作,这是一种罕见的遗传性癫痫症。
同时,这一NDA还包括一项优先审查请求,有望提前4个月结束审查,尽早获批。
此外,Ganaxolone计划在今年晚些时候向欧洲药品管理局提交上市许可申请。
01/ 罕见遗传病:CDKL5缺乏症
CDKL5缺乏症(CDD)是一种严重的罕见遗传疾病,由于位于X染色体上的细胞周期蛋白依赖性激酶样5(CDKL5)基因突变引起的。CDKL5基因负责编码对大脑正常功能至关重要的的蛋白质。

CDD主要影响女孩,其特征是早发且难以控制的癫痫发作,以及严重的神经发育迟缓导致的认知、运动、语言和视觉功能障碍。
早发癫痫可能在新生儿出生后的数小时、数周或者数月内出现,并伴随着肌阵挛的强直发作和强直阵挛性发作,极易误诊。而该病的确诊主要通过基因检测来发现是否存在CDKL5突变。
由于受CDD影响的儿童无法正常走路、说话或自主进食,大多数患儿需要轮椅辅助,生活不能自理。
目前,没有专门批准用于CDD的疗法。而现有的抗癫痫药物治疗效果不佳,CDD患儿只能短暂获益,医疗需求仍未得到满足。
02/ GABA-A受体变构调节剂:Ganaxolone
Ganaxolone是一种新型、口服神经活性类固醇异孕酮和γ-氨基丁酸(GABA)-A受体的正变构调节剂,具有抗焦虑、镇静、抗抑郁和抗抽搐的活性。
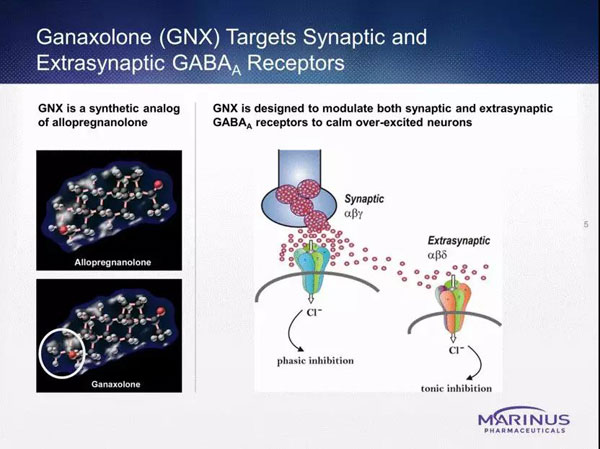
GABA是大脑中主要的抑制性神经递质。而Ganaxolone能特异性靶向并结合到中枢神经系统突触和突触外GABA-A受体-氯离子载体复合物的变构位点;增加GABA对中枢神经系统的抑制作用,抑制神经传递。
通过其对突触和突触外GABA-A受体的作用,抑制了引起癫痫和癫痫持续状态的异常放电,或恢复其他中枢神经系统疾病中受损神经元活动的平衡。
目前,Ganaxolone已在1,800多名儿童和成年患者中进行了长达两年多的研究,涉及各种适应症,包括结节性硬化症和难治性癫痫。此外,该药还被研究开发静脉注射和口服制剂产品。
去年7月,Ganaxolone获得FDA授予的罕见儿科疾病(RPD)指定和“孤儿药”称号,用于治疗与CDD相关的癫痫发作。
03/ 患者癫痫发作频率降低,临床结果亮眼
这一NDA得到了3期Marigold临床试验的积极数据。该研究是一项全球性、双盲、安慰剂对照的试验,入组的2-21岁患者均确定携带疾病相关CDKL5基因变异。
结果显示:
101名接受Ganaxolone治疗的患者,在28天的主要运动癫痫发作频率降低了30.7%,而接受安慰剂治疗的患者仅降低了6.9%,达到了试验的主要终点。
在Marigold开放标签扩展研究中,48名患者接受至少一年的Ganaxolone治疗。研究表明患者的主要运动癫痫发作频率降低了49.6%。
GABA-A受体变构调节剂Ganaxolone的总体耐受性良好,安全性与之前的临床试验一致,最常见的不良事件是嗜睡。
期待该药能早日获批,为CDKL5缺乏症患者带来治疗的新希望!