 医学资讯
医学资讯
 2021-02-24
2021-02-24
胃癌是全球第五大高发恶性肿瘤,尤其高发于日本、中国等东亚国家。与日本相比,中国胃癌的早诊率低,大部分患者诊断时已属晚期,如果单纯依靠常规化疗,很难提高晚期胃癌患者的生存预后。2010年的ToGA临床研究让HER2阳性的胃癌患者正式进入靶向治疗时代,然而此后十年,有明确临床疗效的靶向治疗药物屈指可数。
因此,开发新靶点,并围绕新靶点的药物和诊断的开发是突破胃癌靶向治疗瓶颈的关键。
01、靶向FAK,新的治疗靶点,有效率高!
IN10018是勃林格殷格翰开发的一款FAK高效选择性的小分子抑制剂。应世生物现在拥有该药物的全球开发权,也是在中国唯一的一款正在研发的FAK抑制剂。临床前研究发现IN10018与多西他赛联合在多种肿瘤的动物模型中均观察到很好的协同作用,在弥漫型胃癌的动物模型中与多西他赛联合观察到显著的肿瘤消退和持久的抗肿瘤作用。
已经完成的2项纳入117例受试者的Ⅰ期临床研究表明IN10018对多种瘤种有效,有望成为治疗的新靶点。在纳入的4例胃癌的患者中,有3例弥漫型胃癌患者,其中观察到1例部分缓解(PR)和1例疾病稳定(SD)。IN10018每日一次口服,避免了常规注射的化疗药物的用药不便。IN10018仅观察到了轻微的不良反应。这些不良反应经过对症处理或短暂停药等减轻或恢复。不错的抗肿瘤疗效和良好的耐药性,使IN10018有望成为胃癌治疗的选择之一。
2019年中国国家药监局药品审评中心批准了应世生物针对“局部晚期或转移性胃或食管交界处腺癌”的临床研究。该研究在国内的8家医院开展。
自此,胃癌有新靶点和靶向药了!
02、Claudin 18.2靶向 CART治疗的研究现状!
Claudins是一个蛋白质家族,其作用是维持控制细胞间分子交换的紧密连接。CLDN18.2亚型是一种胃特异性亚型。CLDN18.2通常埋藏在胃粘膜中,正常组织中的单克隆抗体基本上接触不到,恶性肿瘤的发生会导致紧密连接的破坏,使肿瘤细胞表面的CLDN18.2表位暴露出来,成为特定的靶点。
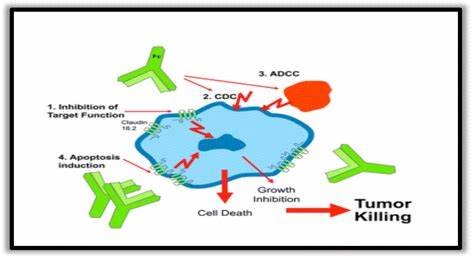
Zolbetuximab(IMAB362,claudixmab)是第一种针对该靶点的开发药物,是一种嵌合的IgG1单克隆抗体,在肿瘤细胞表面与CLDN18.2特异结合,从而引发抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC),凋亡和抑制细胞增殖。
Ⅱa期临床试验(NCT01197885,MONO 2013)研究了其对54例难治性晚期或转移性CLDN18.2阳性胃腺癌患者的疗效和安全性。筛选病人为CLDN18.2阳性和东方肿瘤合作组(ECOG)表现为0-1的患者。
值得注意的是,阳性率定义为在>50%的肿瘤细胞中CLDN18.2染色强度≥2+。研究结果显示,中位无进展生存期(mPFS)提高到14.5周,受试者的平均响应时间延长至24.6周(范围13.1~156.1周)。10例患者获得临床改善,其中PR4例(9%),SD6例(14%),其中90%的患者CLDN18.2高表达。
一项Ⅱb期研究(NCT01630083,FAST 2015)评估了Zolbetuximab与一线表柔比星、奥沙利铂和卡培他滨(EOX)化疗对晚期/复发性胃癌/GEJ患者的疗效。如果肿瘤表达CLDN18.2,而没有HER-2,则符合条件。纳入标准还包括0-1分的ECOG状态。FAST研究显示,实验组和对照组的mPFS分别为7.5个月和5.3个月(危险比(HR)=0.44)。Zolbetuximab联合EOX组的总生存(OS)期获益为13.2个月,而单用EOX组为8.4个月(HR=0.56;95% CI:0.40,0.79),客观缓解率(ORR)更高(39%对25%)。其中完全缓解(CR) 8例(10.4%),PR 22例(28.6%),SD 34例(44.2%)。对照组PR、CR和SD分别为18例(21.4%)、3例(3.6%)和43例(51.2%)。
由于CLDN18.2的高特异性有助于T细胞识别肿瘤,因此被用于嵌合抗原受体T(CAR-T)细胞治疗。正在进行的Ⅰ期研究(NCT03159819)探讨了CLDN18.2特异性CAR-T细胞的临床应用。针对12例CLDN18.2阳性实体瘤患者,其中胃癌7例。在11例可评估的受试者中,1例患者获得CR(胃癌),3例患者获得PR(包括2例胃癌),5例患者获得SD,2例患者PD。胃癌的ORR为42.8%(3/7),总ORR达33.3%,mPFS为130天。
CLDN18.2是继HER-2之后胃癌的第二重要靶点。新型抗体zolbtuximab,无论是单药治疗还是联合化疗,都显示出显著的疗效和安全性。CLDN18.2CAR-T细胞治疗最近以其优异的表现探索了另一种可能性。随着分子结构和临床试验的不断完善,抗CLDN18.2治疗将在未来带来更多惊喜。
治愈血液肿瘤的细胞免疫治疗来攻克胃癌了-靶向Claudin 18.2的CAR-T细胞疗法!
03、针对FGFR2突变,再现一线治疗新靶点
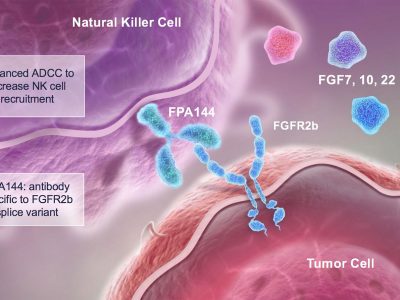
Bemarituzumab是一款靶向成纤维细胞生长因子受体2(FGFR2)的单克隆抗体。FGF/ FGFR通路与癌细胞的生长发育有关。FGFR2b是在胃和皮肤等部位上皮细胞中发现的FGFR的一种亚型。FIGHT研究入组155例初诊的FGFR2b阳性、局部晚期或转移性胃和胃食管交界处腺癌患者,主要评估bemarituzumab联合mFOLFOX6方案相比安慰剂联合mFOLFOX6方案作为一线治疗的疗效和安全性差异。
结果显示,Bemarituzumab组中位PFS较安慰剂组延长2.1个月(7.4 比 9.5个月,HR=0.68),中位OS尚未达到,安慰剂组为12.9个月(HR=0.58);ORR提高了13%(47% 比 33%)。
进一步分析发现,FGFR2b过表达阳性肿瘤细胞占较高的人群,其总生存率更高。其中IHC 2+/3+≥10%的患者中, 12个月的生存率高达70.2%,而安慰剂组只有49.5%的生存率。除此之外,IHC 2+/3+≥10%患者的死亡风险降低了59%。
两组患者所有等级的不良反应事件基本相似。FIGHT试验是第一个评估靶向FGFR2b过表达的研究,通过中心进行的IHC检测,大约30%的HER2阴性胃和胃食管交界处腺癌患者会过度表达FGFR2b。在mFOLFOX6化疗中加入Bemarituzumab后,PFS、OS和ORR有了临床意义和统计学意义上的显著改善。Bemarituzumab与角膜不良事件和口腔炎的增加相关,其中大多数是可逆的。
04、靶向HER2 ADC药物DS-8201,有效率创新高!
2020年5月12日, Enhertu(trastuzumab deruxtecan,DS-8201)后线治疗胃癌就获得FDA授予的突破性疗法认定,2020年9月25日正式在日本获批,2021年1月16日,该适应症正式获得FDA批准。
DS-8201是一种新一代抗体药物偶联物(ADC),通过一种4肽链接子将靶向HER2的人源化单克隆抗体trastuzumab(曲妥珠单抗)与一种新型拓扑异构酶1抑制剂exatecan衍生物(DX-8951衍生物,DXd)链接在一起,可靶向递送细胞毒制剂至肿瘤细胞内。
好医友了解到,DESTINY-Gastric01是一项开放、随机、II期试验,评估了DS-8201对HER2阳性晚期胃癌患者的疗效。纳入接受至少两次治疗的HER2阳性胃或胃食管交界处腺癌患者,随机分组,分别接受DS-8201(6.4mg/kg,q3w)或化疗。研究结果表明,接受Enhertu治疗的患者整体缓解率51.3%,而接受化疗的患者整体缓解率仅有14.3%。在生存期方面,接受Enhertu治疗的患者中位总生存期12.5个月,接受化疗的患者中位总生存期为8.4个月。