 医学资讯
医学资讯
 2021-01-12
2021-01-12
胃癌是目前世界上最常见的恶性肿瘤之一,其发病率和病死率在中国位居第2位,世界范围内其发病率排名第5位、病死率排第2位。目前对于胃癌的治疗方式主要以手术结合系统性化疗为主,早期胃癌通常预后较好,但对于局部进展期不可切除性和转移性胃癌其预后较差,对于此类患者,通常认为无法治愈,其治疗目的以缓解症状和尽可能延长生存期为主,目前的治疗方案主要是以全身综合性系统性化疗。
01、肿瘤疫苗
肿瘤疫苗类型包括树突状细胞(DC)、T细胞、DNA、RNA、病毒载体、蛋白质、多肽等,其目的是通过诱导免疫系统识别并攻击肿瘤细胞。早期的肿瘤疫苗主要是靶向自体抗原,但自体抗原很难诱导免疫系统产生特异性杀伤细胞。新生抗原是一类在肿瘤发生、发展过程中由于其基因突变,经过转录翻译后可产生表达于主要组织相容性复合体(MHC)的特异性抗原肽。新生抗原仅表达于肿瘤细胞,具有肿瘤特异性。基于新生抗原的高度特异性,通过高通量测序技术测序和比较所有肿瘤外显子并从中筛选出能被T细胞识别且诱发免疫反应的新生抗原是新一代个体化肿瘤疫苗制备的基础。
目前为止,仅有一种肿瘤疫苗被FDA批准。2010年,provenge获批成为首个治疗无症状或微症状转移性去势抵抗性前列腺癌的肿瘤疫苗产品,其机制是采集患者外周血单核细胞,将前列腺酸性磷酸酶与粒细胞-巨噬细胞集落刺激因子共培养,培养产物即以前列腺酸性磷酸酶为靶向的抗原提呈细胞,将抗原提呈细胞回输至患者体内后便可刺激T细胞,激活免疫反应从而起到靶向杀伤肿瘤细胞的作用。
针对胃癌的肿瘤疫苗治疗在早期已有报道,采用HER2/DC疫苗对9例晚期胃癌患者的治疗后,1例患者临床症状缓解,另有1例患者出现了3个月稳定期;另一项采用MAGE-A3/DC治疗晚期胃癌的试验中,4例患者检测到了抗原特异性T细胞,其中3例患者疾病有一定程度的缓解。
在胃癌中由于肿瘤细胞异质性高,而早期的靶向自体抗原的肿瘤疫苗疗效不稳定,基于高通量测序的新生抗原识别和筛选程序复杂,疫苗制备的时间周期长,如何个体化筛选抗原,选择能有效刺激激活肿瘤细胞的抗原等问题仍需要克服。就目前的研究结果来看,新一代靶向新生抗原的个体化肿瘤疫苗具有巨大的应用潜力,但其进一步治疗方案以及联合免疫检查点抑制剂治疗仍需进一步探索。
02、过继性免疫治疗
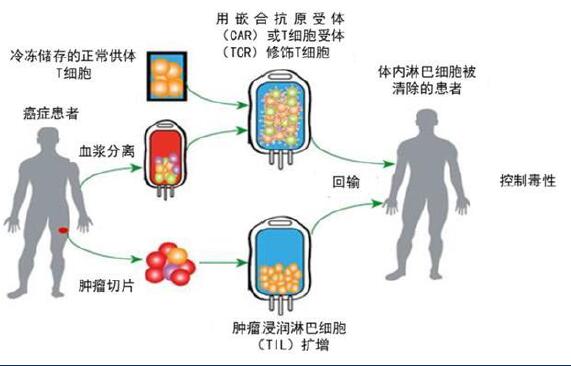
过继性免疫治疗是通过体外分选、培养并筛选出具有特异性识别和杀伤肿瘤细胞能力的免疫细胞,并将其回输至患者体内起到治疗作用的一种疗法,其依照过继性免疫活性细胞的种类不同、针对的目标靶点、免疫调节激活途径以及产生杀伤作用的效应细胞的不同又可分为多种类型。
最早出现的一类过继性细胞免疫治疗是淋巴因子激活杀伤细胞和DC诱导的杀伤细胞,这两类细胞对于肿瘤的特异性识别和杀伤能力较差,目前已经逐渐被淘汰,鲜有报道。
另一类过继性免疫细胞治疗是以T细胞受体基因工程改造的T细胞(TCR-T)和嵌合抗原受体T细胞(CAR-T)为代表的基因工程改造的细胞。
TCR-T疗法是一种以修饰T细胞为基础的肿瘤过继免疫治疗方法。Lu等在对TIL治疗黑色素瘤的研究中发现了有部分T细胞表面具有肿瘤特异性T细胞受体,通过对T细胞受体进行改造,构建具有能够特异性识别肿瘤细胞的T细胞,通过体外扩增并回输至患者体内进行治疗,可以提高免疫细胞抗肿瘤的效应并降低自身免疫损伤等不良反应。但由于肿瘤的异质性存在,并非所有肿瘤都能表达出同样的特异性抗原,这也是TCR-T治疗的局限性所在。TCR-T临床试验目前多数处于Ⅰ期/Ⅱ期临床试验阶段,其中有NCT03638206和NCT03941626将胃癌作为适应证之一,目前正处于纳入患者阶段,尚无疗效报道。
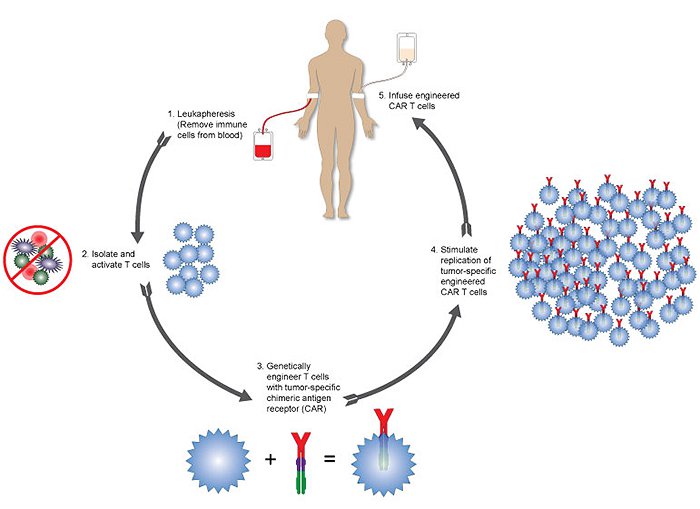
CAR-T疗法目前是最成功的过继性免疫疗法之一。CAR-T治疗是选择针对的细胞表面抗原,T细胞取自患者自身的T细胞于体外改造,使其表达B细胞受体的抗原结合区,使得该区域与CD3 T细胞受体的胞内结构域融合,就可以不依赖MHC也能特异性识别细胞表面抗原,激活T细胞应答。
到目前为止,CAR-T技术已经发展到第4代,CAR-T治疗在血液系统类型肿瘤中应用最为成功,目前已有靶向CD19针对B细胞急性淋巴细胞白血病的临床试验取得了巨大的成功,目前已被FDA批准上市。但是与血液系统中的治疗不同,在实体肿瘤中的CAR-T治疗进展缓慢。
CAR-T的治疗效果受限于治疗靶点即肿瘤抗原的选择,构建的嵌合抗原受体若不能特异性识别肿瘤细胞将可能导致严重的不良反应,甚至危及生命。目前在美国ClinicalTrail网站注册的针对胃癌的CAR-T临床试验有13项,其中来自中国的临床研究有10项,其余3项来自美国。目前多数仍在招募患者阶段,大规模临床应用研究尚未开展,目前也并未无相关疗效报道。
好医友表示,近年来,肿瘤的免疫治疗受到了来自全世界的广泛关注,以抗PD-1/PD-L1为代表的免疫检查点抑制治疗在晚期胃癌的治疗中已经展现了巨大的治疗潜力,但目前仍有许多亟待解决的问题。首先,免疫治疗应用有效的患者范围较小,目前仅有PD-L1阳性、dMMR或2种以上常规治疗失败的患者可获得批准使用PD-1单抗,而仍有大部分患者尚未被证实能从免疫检查点抑制治疗中获益;其次,免疫检查点抑制剂的疗效筛选指标也尚不明确,KEYNOTE-061的结果显示,PD-L1的表达情况并不能有效预测抗PD-1治疗的成功率,其他如dMMR和EBV阳性也有潜力成为预测指标,但仍需进一步的探索;此外,肿瘤疫苗和过继性细胞治疗目前的临床研究数据较少,在既往针对其他类型肿瘤(如黑色素瘤)的治疗中展现了良好的效果,但目前并无证据证明其在胃癌治疗中的有效性;最后,现有的治疗方案与免疫治疗联合使用的疗效仍需更多的临床试验去探索,其结果值得期待。